“卓识远见,传承创新”系列公益讲座第四期质量控制专场顺利举办 日期:2023-01-11 浏览:855
新年伊始,在中国食品药品企业质量安全促进会与中国医药新闻信息协会的组织领导下,由中国食药促进会临床研究管理专业委员会主办、北京卓越未来国际医药科技发展有限公司承办、北京亦庄国际投资发展有限公司协办的“卓识远见,传承创新”系列公益讲座第四期于2023年1月10日在线上成功举办。本期讲座特邀青岛大学附属医院曹玉主任、山东大学齐鲁医院王白璐主任、山西医科大学第二医院王晓霞主任对临床研究质控热点问题进行深入剖析,现进行专场学术要点回顾。
新药研究开发上市必须经过临床试验,其研究资料和结果是药品监督管理部门进行新药审批的关键依据,在研究过程中保证药物临床试验质量至关重要。本期“卓识远见,传承创新”系列公益讲座聚焦于临床试验过程中的质量控制,特别邀请业内3位具有丰富临床研究经验的机构办主任进行经验分享。本期主持人为天津艾迪特医药科技有限公司总经理贾建国先生。
曹玉主任就《新形势下临床试验研究者应具备的能力与要求》进行了精彩分享。曹玉主任指出,临床试验研究者在临床试验项目把控能力、主体责任履职能力、GCP意识、角色转换能力、对临床试验的重视程度、专业能力、入组能力等方面差异较大,多中心临床试验项目整体质量提升任重道远。研究者应充分认识开展临床研究的重要性,掌握临床试验技术和临床试验方案的设计,做好临床试验研究风险防控,并高质量管理临床试验用药品,保证源文件数据的真实完整规范,同时有能力做好安全性信息处理与报告。研究者在临床试验中应履行的职责详见图1。

图1 曹玉主任:新形势下研究者临床试验中应履行的职责
王白璐主任进行了《临床试验新机构建设与运行》的主题报告。机构管理体系建设包括人员管理、培训体系建设、管理制度与SOP建立、药物管理、设施设备以及质量保证体系等多个模块。在临床试验项目的实施阶段,全流程包括方案设计及方案讨论、机构立项、伦理审核、签订合同及人遗申报、省局备案、召开项目启动会、受试者知情及筛选、随机入组、受试者随访、答疑、数据清理、总结及资料归档(详见图2)。王白璐主任在每个环节都进行了详细的讲解,并对创新机构建设与运行提出了自己的见解。
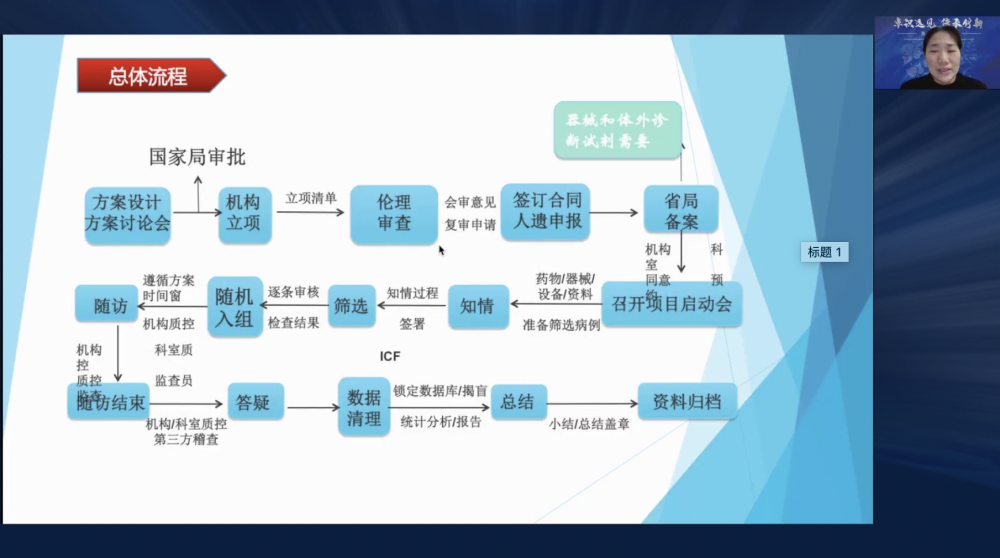
图2 王白璐主任:临床试验项目全流程
王晓霞主任从风湿免疫药物临床试验出发,结合经典案例,分享了《风湿免疫药物临床试验常见问题及案例分析》。国内外风湿免疫性疾病研发靶点主要集中在生物改善病情抗风湿药(bMARDs)和靶向合成缓解病情抗风湿药物(tsDMARD),方案设计多以量表评估为结局指标,临床试验操作环节需关注疾病特点及病情波动。王晓霞主任结合实际案例进行了常见问题剖析,从理论落地到实际,详见图3。最终,王主任指出新药从研发到上市,各个环节环环相扣,优质的项目质量有赖于各方的共同努力,协调一致。
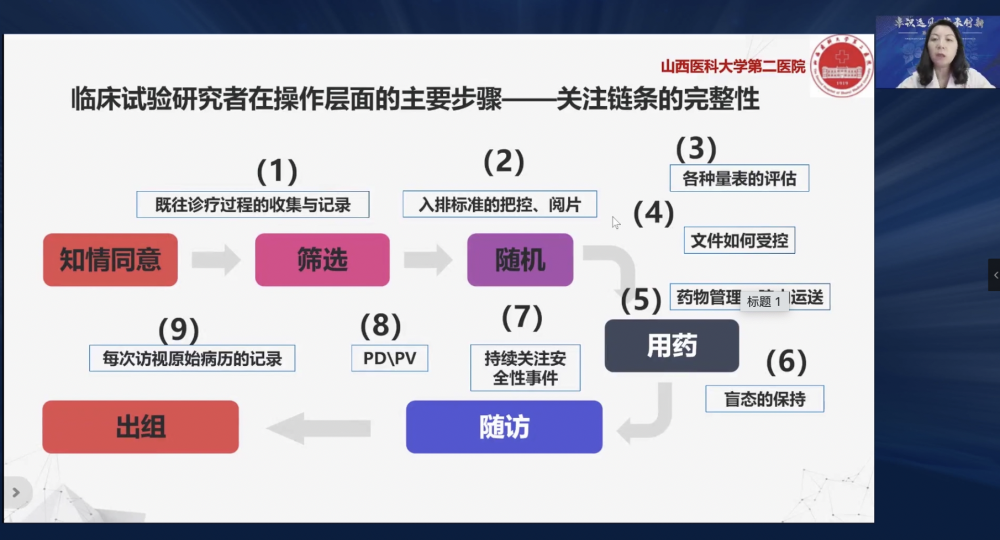
图3 王晓霞主任:临床研究者在操作层面的主要步骤——关注链条的完整性
“卓识远见,传承创新”系列公益讲座将于每月10日及20日20:30-22:00在线上滚动播出,期待您的实时关注。