第三届“有源医疗器械注册检验及电气安全技术论坛”通知 日期:2023-04-20 浏览:761
各有关单位:
2021年6月1日《医疗器械监督管理条例》正式实施,相关配套法规相继颁布,给产品注册申报工作带来新的变化和更大的挑战。为使从事医疗器械注册工作的人员更好地理解有关政策法规,熟悉医疗器械注册审评的工作程序与要求,掌握各类医疗器械注册申报中的有关审评技术要求和注意事项,有效提高注册申报工作的质量与效率,为了帮助相关人员尽快掌握新法规,中国食品药品企业质量安全促进会医疗器械分会联合国药励展定于87届CMEF展会期间举办第三届“有源医疗器械注册检验及电气安全技术论坛”,论坛将围绕有源医疗器械注册申报、不良事件检查、标准变化、软件相关标准、生产过程的风险管理、临床评价等方面进行分享。
具体通知如下:
一、组织架构
主办单位:
中国食品药品企业质量安全促进会医疗器械分会
国药励展有限责任公司
学术支持:
DEKRA德凯
迈迪思创(北京)科技发展有限公司
苏州熠品质量技术服务有限公司
深圳华通威国际检验有限公司
苏州旭阜医疗器械技术服务有限公司
二、时间地点
时 间:2023年5月15日(全天)
地 点:上海国家会展中心·M204会议室(会展大道1-2号馆层)
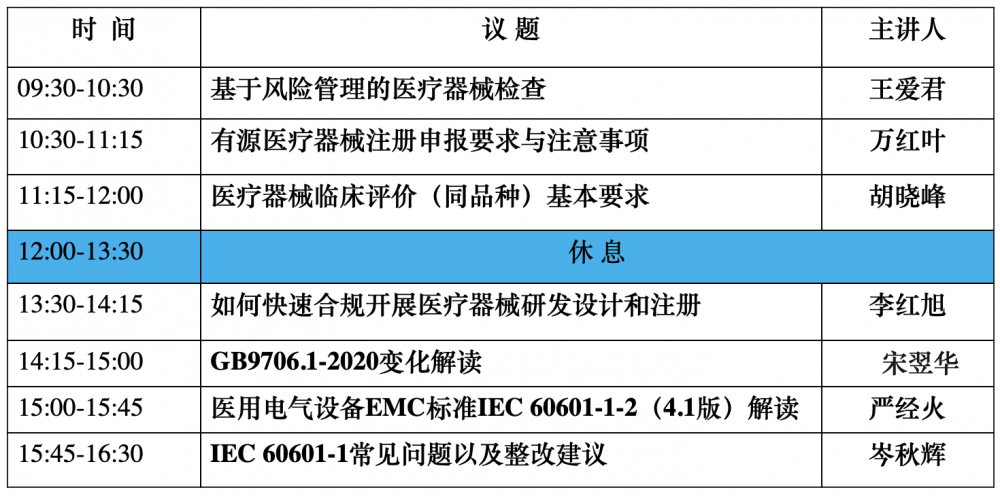
三、论坛日程
四、嘉宾介绍
王爱君
主任药师,国家局审核查验中心检查五处原处长;执笔起草制定了境外医疗器械检查规范、供应商审核管理办法、体外诊断试剂实施细则解读等,组织修订中国医疗器械GMP、无菌、植入性医疗器械、体外诊断试剂附录及其检查指导原则等;曾担任AHWP第25届第7工作组(质量管理体系执行与运行)主席、医疗器械分类技术委员会执行委员会委员、医疗器械质量管理和通用要求标准化委员会(SAC/TC221)委员;
万红叶
迈迪思创(北京)科技发展有限公司注册检测部总监;拥有12年医疗器械注册检测与临床试验工作经验,长期从事注册检测一线管理与实施工作。熟悉医疗器械注册、检测、临床试验相关法规要求与技术标准,擅长进口与国产医疗器械首次注册、延续注册与变更注册等申报工作,已主导与参与完成上百张II类、III类医疗器械注册证书。
胡晓峰
苏州大学MBA;德能医学服务集团副总经理/合伙人;苏州旭阜医疗器械技术服务有限公司总经理;苏州市医疗器械行业协会特聘讲师;宁波市医疗器械行业协会顾问专家;10余年医疗器械项目管理经验,对医疗器械全生命周期的运营有着丰富的经验,擅长策划医疗器械产品上市的整体解决方案;
李红旭
中检华通威医学健康产品线法规总监;拥有医疗器械NMPA、FDA 510(k)、CE认证、研发和生产体系超过15年的实战经验;精通多国医疗器械(含IVD)法规及通用标准。医疗器械行业高级咨询师,多家知名机构及协会的特聘讲师;
宋翌华
苏州熠品电气安全实验室经理;苏州大学电子信息专业学士学位;多年有源医疗器械一线检验检测经历,熟悉GB9706.1,IEC60601等医疗器械相关产品标准;熟悉各类有源医疗器械,对有源医疗器械设计整改有丰富的项目经验;
严经火
DEKRA德凯广州EMC/RF资深认证测试专家;10余年测试认证行业工作经验及产品EMC研发设计经验,主要负责多国、多地区EMC/RF测试及认证相关服务,深入了解市场需求;
岑秋辉
DEKRA德凯广州医疗电子高级经理;从事医疗器械检测和认证工作14年,具有丰富的医疗器械安规和性能的检测经验以及解决方案设计。为近百家国内外企业服务,并获得客户的好评。
五、报名方式

本次论坛免费、大家扫码报名
六、联系方式
联系人:张老师
电 话:010-52134332
邮 箱:yiliaoqixiefenhui@126.com
中国食药促进会医疗器械分会
2023年4月20日