关于举办“药物/医疗器械临床试验质量管理规范高级研修班(首都医科大学附属北京同仁医院专场)暨中国食品药品企业质量安全促进会临床研究管理专业委员会第三次学术会议”的通知(第二轮) 日期:2023-11-16 浏览:540
各位专家、委员、医疗机构、制药企业、CRO、SMO 及相关单位:
2023年度国家相关部门相继修订与实施《人源性干细胞及其衍生细胞治疗产品临床试验技术指导原则(试行)》、《以患者为中心的药物临床试验实施技术指导原则(试行)》、《涉及人的生命科学和医学研究伦理审查办法》、《科技伦理审查办法(试行)》等一系列法规;临床研究行业面临全方位质量要求,临床试验机构和临床试验从业人员亦需要增强临床研究管理及临床研究知识技能的全面提高。
为了让各医疗机构研究者,医药行业临床试验从业人员,能够及时了解我国关于药物临床试验最新法律法规,以及基本实践环节和规范化要求;临床研究管理专委会本着“规范、促进、协作、提升”的工作宗旨,拟于2023年11月于北京举办“药物/医疗器械临床试验质量管理规范高级研修班(首都医科大学附属北京同仁医院专场)暨中国食品药品企业质量安全促进会临床研究管理专业委员会第三次学术会议”来讨论新的研究发现、最佳实践和未来趋势,以推动药物研发领域的创新和卓越。
会议将邀请国内知名临床研究管理及GCP领域专家进行专题授课,让参会者了解最新的临床研究管理领域研究进展和政策解读。
现将有关事项通知如下:
一、组织机构
主办方:
中国食品药品企业质量安全促进会临床研究管理专业委员会
承办方:
首都医科大学附属北京同仁医院
二、会议基本信息
会议时间:
2023年11月25-26日
会议形式:
线上直播:
将于11月25日8:30开启。届时,学员可通过以下链接或二维码,观看会议直播;
参会链接:
https://kyhxw.h5.xeknow.com/sl/giK2B
参会二维码:

参会对象:
中国食药促进会临床研究管理专业委员会全体委员;医疗机构的医务人员、科研管理人员和临床试验管理人员,生物医药企业、CRO、SMO 等相关人员
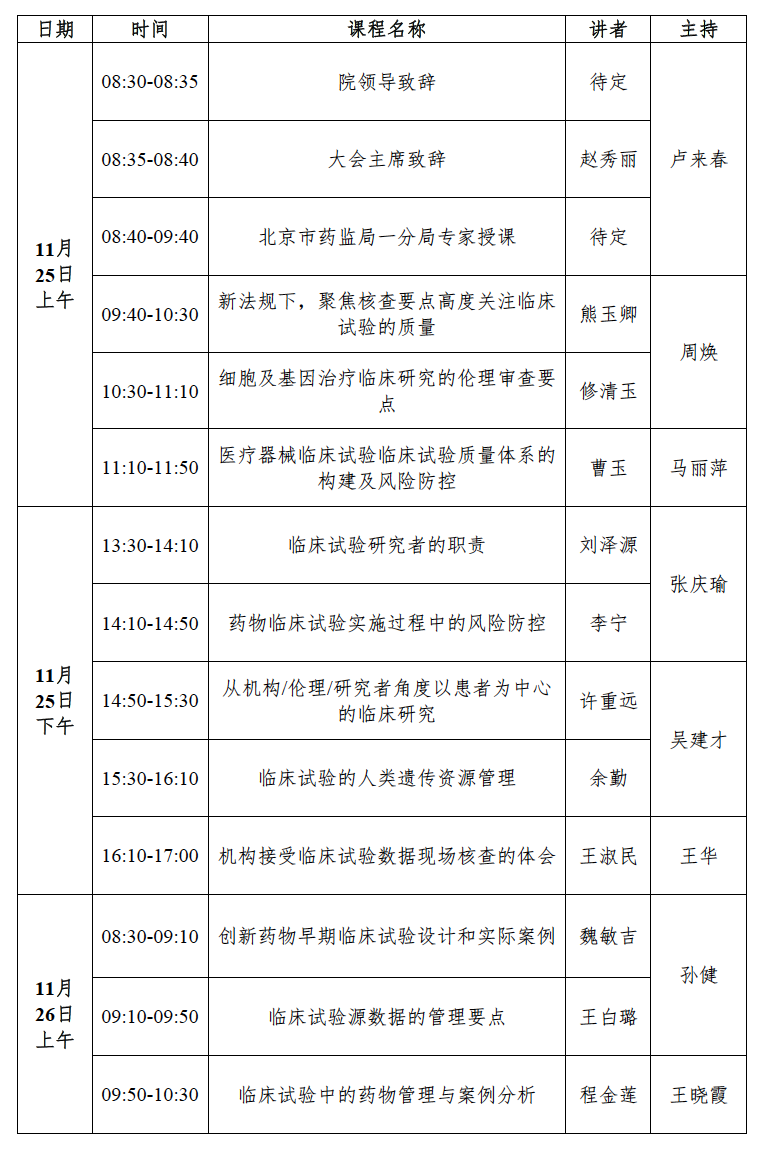
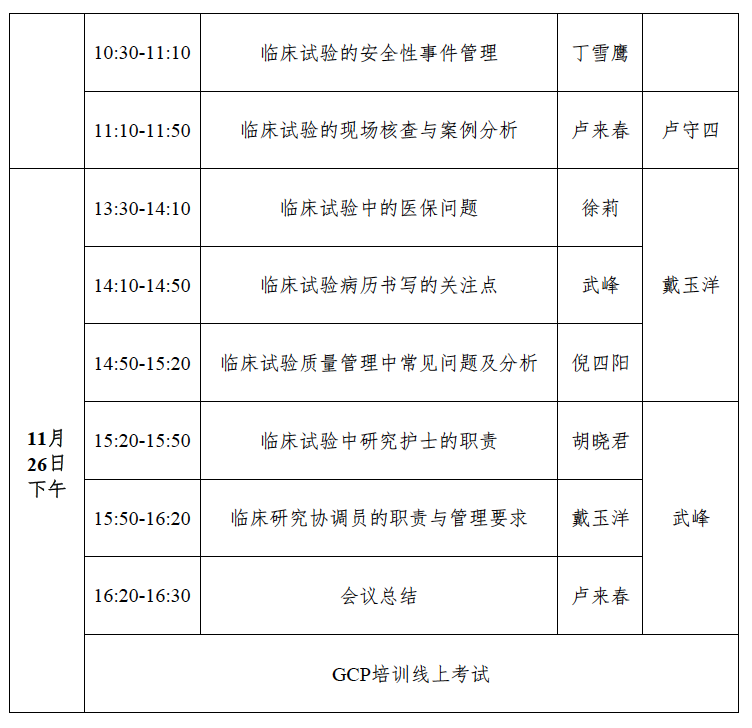
三、会议日程
四、会议注册及费用缴纳
1.会议注册方式:
请准确填写报名表(见附件),并发送至邮箱:wlzjb@chncro.com。
2.会议注册费用:
中国食品药品企业质量安全促进会临床研究管理专业委员会委员免费;
非委员参会注册费: 每人¥ 1000.00元(大写壹仟元整)。
费用包括证书、培训费、考试费等。
电子发票及证书将在会议结束后两周内邮件发送。
3.缴费方式:
只支持银行/电子汇款,不支持现场缴费。
全称:中国食品药品企业质量安全促进会
账号:0200151819100095482
开户行:中国工商银行北京自贸试验区永丰基地支行
(汇款时请备注“高级研修班同仁专场+参会人姓名”)
请在2023年11月25日之前(含当天)完成注册并缴纳会议注册费,注册以缴费成功为准。
五、联系我们
会议事务:
戴老师:13811057723 贾老师:15010378120
六、培训证书
培训结束后线上考核二维码将发送到直播间,扫描二维码参加线上考核。参加线上学习并经考核合格后将获得由中国食品药品企业质量安全促进会临床研究管理专业委员会颁发的“药物/医疗器械临床试验质量管理规范高级研修班”培训证书。
中国食品药品企业质量安全促进会临床研究管理专业委员会
2023年11月14日