“卓识远见,传承创新”系列公益讲座第十一期临床研究质控核查专场顺利举办 日期:2023-04-21 浏览:639
2023年04月20日,由中国食品药品企业质量安全促进会、中国医药新闻信息协会指导,中国食药促进会临床研究管理专业委员会主办、北京卓越未来国际医药科技发展有限公司承办、北京亦庄国际投资发展有限公司协办的“卓识远见,传承创新”系列公益讲座第十一期在云端与各位同行如约而至。本期讲座特邀吉林大学中日联谊医院临床研究管理部魏君主任、蚌埠医学院药物分析教研室马涛主任就《临床研究项目实施前预考核工作的实践与思考》、《生物样品分析现场核查》进行授课。现进行学术专场要点回顾。本场专题讲座主持人为北京卓越天使医药科技发展有限公司东北事业部总监吕燕鹏先生。
魏主任分享其多年关于临床研究项目实施前预考核工作的实践与思考要点。对于如何打造临床研究科室品牌,魏主任建议需要从研究者的专业和投入程度出发,基于项目入组速度、项目完成质量以及研究者的学术声誉,评估研究者的有效投入时间、既往培训效果以及质控整改的执行力。在准备临床研究项目实施前预考核工作时,需要构建启动前预考核团队,对任务进行拆解,寻找考核关键点,制定考核计划和方案,实施考核,进行考核效果反馈和改进。
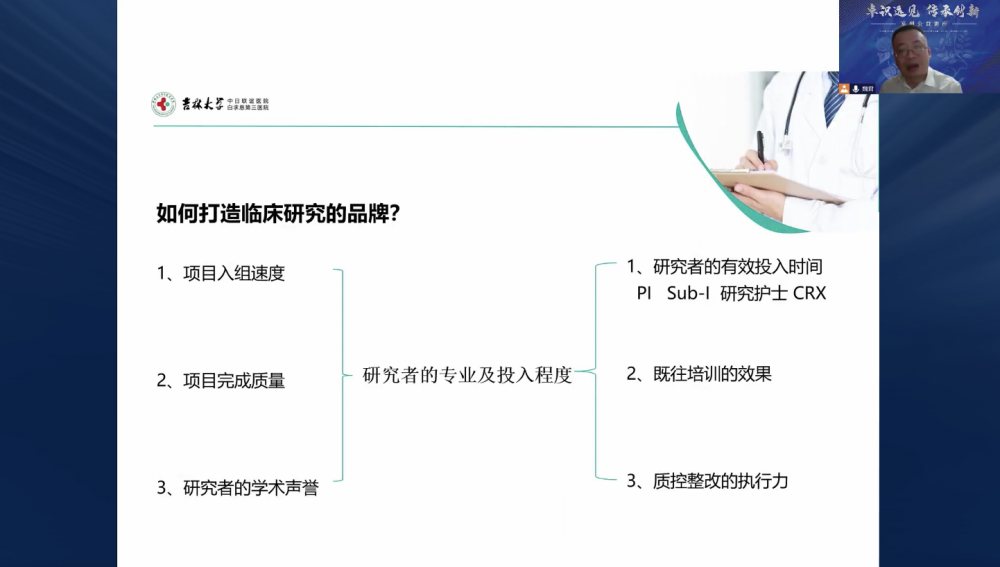
魏君主任:如何打造临床研究的品牌
马主任围绕生物样品分析现场核查要点分享了自己体会。生物样品分析条件与合规性方面,分析检测单位需具备承担生物样品分析项目的至少以下条件:组织机构设置合理,具有组织机构图,配有可满足分析检测要求的取样、称量、配制、检测及数据分析的仪器及软件,配备相应的安全防护、应急和急救设施设备。分析检测单位与申办者或合同研究组织(CRO)签署委托合同,明确试验各方的责任、权利和利益,以及各方应当避免的、可能的利益冲突。申办者、CRO按照药物临床试验质量管理规范原则、方案及合同规定承担相应职责,并保存相应文件和记录。依据《药品注册核查要点与判定原则(药物临床试验)(试行)》,马主任对“生物样品分析部分现场核查要点”部分进行了详尽阐述。

马涛主任:药物注册核查要点与判定原则
北京卓越未来国际医药科技发展有限公司是一家专注为药品、医疗器械研发及生产企业、科研机构等提供专业临床试验全产业链技术服务的合同研究组织(CRO),成立于2002年。北京卓越未来国际医药科技发展有限公司将进一步推动我国医药研发、助力临床科研水平的提升。“卓识远见,传承创新”系列公益讲座将于每月10日及20日20:30-22:00在线上滚动播出,期待您的实时关注。